ザガーロの副作用について
ザガーロの副作用として最も多く報告されているのは性機能関連で、勃起不全、性欲減退、射精障害などがあり、投与量にかかわらず一定の割合で発生していますが、大半は軽度で、重篤な症例はほとんど報告されていません。
国内の長期投与試験(52週間)では、副作用の報告率は17%で、最も頻度が高かったのは勃起不全と性欲減退でしたが、試験が非盲検だったことから、先入観による影響も一定程度考慮する必要があります。
投与中止後も性機能障害が続くとする報告も一部ありますが、発生頻度は極めて低く、その因果関係やメカニズムは明確ではないため、注意喚起はされつつも、過度な心配は不要と考えられています。
総症例557 例の項目別副作用
第Ⅱ/Ⅲ相国際共同試験において、本剤が投与された総症例557 例(日本人120 例を含む)中、95 例(17.1%)に臨床検査値異常を含む副作用が報告された。その主なものは、勃起不全24 例(4.3%)、リビドー減退22 例(3.9%)、精液量減少7 例(1.3%)であった。
以下の表はザガーロの主成分であるデュタステリドを成人男性に1日回、用量別(0.02mg、0.1mg、0.5mg)に投与させた臨床データです。
| デュタステリド0.02mg 群 | デュタステリド0.1mg 群 | デュタステリド0.5mg 群 | |
|---|---|---|---|
| 評価症例数 | 185 | 188 | 184 |
| 副作用発現例数(発現率) | 26(14%) | 39(21%) | 30(16%) |
| 副作用名 | 発現症例数(発現率) | ||
| 生殖系および乳房障害 | 12(6%) | 10(5%) | 14(8%) |
| 勃起不全 | 8(4%) | 6(3%) | 10(5%) |
| 射精不能 | 1 (1%未満) | 2(1%) | 1 (1%未満) |
| 射精障害 | 0 | 3(2%) | 2(1%) |
| 性機能不全 | 2(1%) | 1 (1%未満) | 1 (1%未満) |
| 乳房腫大 | 0 | 1 (1%未満) | 0 |
| 射精遅延 | 1 (1%未満) | 0 | 0 |
| 精巣痛 | 0 | 0 | 1 (1%未満) |
| 乳頭痛 | 1 (1%未満) | 0 | 0 |
| 精液変色 | 0 | 0 | 1 (1%未満) |
| 精神障害 | 13(7%) | 14(7%) | 4(2%) |
| リビドー減退 | 9(5%) | 9(5%) | 4(2%) |
| リビド消失 | 2(1%) | 2(1%) | 0 |
| 不安 | 1 (1%未満) | 1 (1%未満) | 0 |
| 早漏 | 1 (1%未満) | 0 | 0 |
| 抑うつ気分 | 0 | 1 (1%未満) | 0 |
| うつ病 | 0 | 1 (1%未満) | 0 |
| 神経過敏 | 1 (1%未満) | 0 | 0 |
| 抑うつ症状 | 0 | 1 (1%未満) | 0 |
| 胃腸障害 | 6(3%) | 6(3%) | 4(2%) |
| 腹痛 | 2(1%) | 4(2%) | 0 |
| 上腹部痛 | 2(1%) | 0 | 1 (1%未満) |
| 腹部膨満 | 1 (1%未満) | 1 (1%未満) | 0 |
| 下痢 | 0 | 1 (1%未満) | 1 (1%未満) |
| 鼓腸 | 1 (1%未満) | 0 | 0 |
| 腹部不快感 | 1 (1%未満) | 0 | 0 |
| 消化不良 | 0 | 1 (1%未満) | 1 (1%未満) |
| 歯の知覚過敏 | 0 | 1 (1%未満) | 0 |
| 消化管刺激症状 | 0 | 0 | 1 (1%未満) |
| 臨床検査 | 2(1%) | 6(3%) | 5(3%) |
| 精液量減少 | 2(1%) | 3(2%) | 2(1%) |
| トランスアミナーゼ上昇 | 0 | 2(1%) | 2(1%) |
| アラニン・アミノトランスフェラーゼ増加 | 0 | 0 | 1 (1%未満) |
| 体重増加 | 0 | 1 (1%未満) | 0 |
| 神経系障害 | 2(1%) | 3(2%) | 1 (1%未満) |
| 頭痛 | 0 | 1 (1%未満) | 0 |
| 傾眠 | 1 (1%未満) | 2(1%) | 0 |
| 浮動性めまい | 1 (1%未満) | 0 | 1 (1%未満) |
| 皮膚および皮下組織障害 | 1 (1%未満) | 2(1%) | |
| そう痒症 | 0 | 1 (1%未満) | 1 (1%未満) |
| 毛髪成長異常 | 1 (1%未満) | 0 | 0 |
| 多汗症 | 1 (1%未満) | 0 | 0 |
| 発疹 | 0 | 0 | 1 (1%未満) |
| 感染症および寄生虫症 | 1 (1%未満) | 1 (1%未満) | 3(2%) |
| 鼻咽頭炎 | 1 (1%未満) | 0 | 3(2%) |
| 癜風 | 0 | 1 (1%未満) | 0 |
| 腎および尿路障害 | 2(1%) | 1 (1%未満) | 0 |
| 尿意切迫 | 2(1%) | 0 | 0 |
| 頻尿 | 1 (1%未満) | 0 | 0 |
| 着色尿 | 0 | 1 (1%未満) | 0 |
| 代謝および栄養障害 | 1 (1%未満) | 0 | 0 |
| 食欲亢進 | 1 (1%未満) | 0 | 0 |
| 血液およびリンパ系障害 | 0 | 0 | 1 (1%未満) |
| 貧血 | 0 | 0 | 1 (1%未満) |
| 筋骨格系および結合組織障害 | 0 | 0 | 1 (1%未満) |
| 筋膜疼痛症候群 | 0 | 0 | 1 (1%未満) |
| 呼吸器、胸郭および縦隔障害 | 0 | 1 (1%未満) | 0 |
| 鼻閉 | 0 | 1 (1%未満) | 0 |
| 血管障害 | 0 | 2(1%) | 0 |
| 高血圧 | 0 | 2(1%) | 0 |
| 心臓障害 | 0 | 0 | 1 (1%未満) |
| 頻脈 | 0 | 0 | 1 (1%未満) |
| 傷害、中毒および処置合併症 | 1 (1%未満) | 0 | 0 |
| 筋断裂 | 1 (1%未満) | 0 | 0 |
日本人120例の項目別副作用詳細
日本人120 例中、臨床検査値異常を含む副作用が報告された症例は14 例(11.7%)であった。その主なものは、リビドー減退7 例(5.8%)、勃起不全6 例(5.0%)、射精障害2 例(1.7%)であった。(承認時)
| デュタステリド0.02mg 群 | デュタステリド0.1mg 群 | デュタステリド0.5mg 群 | |
|---|---|---|---|
| 評価症例数 | 40 | 40 | 40 |
| 副作用発現例数(発現率) | 3(8%) | 5(13%) | 6(15%) |
| 副作用名 | 発現症例数(発現率) | ||
| 生殖系および乳房障害 | 1(3%) | 3(8%) | 4(10%) |
| 勃起不全 | 1(3%) | 1(3%) | 4(10%) |
| 射精障害 | 0 | 1(3%) | 1(3%) |
| 乳房腫大 | 0 | 1(3%) | 0 |
| 性機能不全 | 0 | 1(3%) | 0 |
| 精神障害 | 2(5%) | 3(8%) | 2(5%) |
| リビドー減退 | 2(5%) | 3(8%) | 2(5%) |
| 胃腸障害 | 1(3%) | 0 | 1(3%) |
| 腹部不快感 | 1(3%) | 0 | 0 |
| 消化不良 | 0 | 0 | 1(3%) |
| 血液およびリンパ系障害 | 0 | 0 | 1(3%) |
| 貧血 | 0 | 0 | 1(3%) |
国内長期投与試験(52週間長期投与)での副作用
ザガーロ0.5mgが投与された症例数120例中20例(17%)に臨床検査値異常を含む副作用が報告された。その主なものは、勃起不全13例(11%)、リビドー減退10例(8%)、射精障害5例(4%)、性機能不全4例(3%)であった。対象:20~50歳の日本人男性型脱毛症患者120例方法:多施設共同・非盲検試験 *3)ザガーロ0.5mgを1日1回52週間経口投与した際の安全性、忍容性および有効性を検討した。
*3) 非盲検試験とは、オープン試験ともいい、被験者、医師、スタッフに「被験者がどの治療群に割り当てられたか」をオープンにして行われる試験。デメリットとして評価をする医師、データを解析するスタッフが内容を知ってしまっていることで評価に何らかの偏りが生じてしまう可能性があります。要は被験者と医師に知らされているため治験対象薬に対する先入観や予備知識などから副作用発現頻度も高くなる可能性が十分に考えられるということです。
| 副作用 | 発現症例数(発現率) |
|---|---|
| 生殖系および乳房障害 | 17 (14%) |
| 勃起不全 | 13 (11%) |
| 射精障害 | 5 (4%) |
| 性機能不全 | 4 (3%) |
| 逆行性射精症 | 1 (1%未満) |
| 精神障害 | 11 (9%) |
| リビドー減退(性欲減退) | 10 (8%) |
| 抑うつ気分 | 1 (1%未満) |
| 自殺念慮 | 1 (1%未満) |
| 神経系障害 | 2 (2%) |
| 頭痛 | 1 (1%未満) |
| 感覚障害 | 1 (1%未満) |
| 一般・全身障害および投与部位の状態 | 1 (1%未満) |
| 疲労 | 1 (1%未満) |
| 皮膚および皮下組織障害 | 1 (1%未満) |
| 発疹 | 1 (1%未満) |
| 血管障害 | 1 (1%未満) |
| 高血圧 | 1 (1%未満) |
その他の副作用
| 1% 以上 | 1% 未満 | 頻度不明 *1) | |
|---|---|---|---|
| 過敏症 | 発疹 | 蕁麻疹、アレルギー反応、そう痒症、限局性浮腫、血管浮腫 | |
| 精神神経系 | 頭痛、抑うつ気分 | 浮動性めまい、味覚異常 | |
| 生殖系及び乳房障害 | 性機能不全(リビドー減退、勃起不全、射精障害)*2) | 乳房障害(女性化乳房、乳頭痛、乳房痛、乳房不快感) | 精巣痛、精巣腫脹 |
| 皮膚 | 脱毛症(主に体毛脱落)、多毛症 | ||
| 消化器 | 腹部不快感 | 腹痛、下痢 | |
| その他 | 肝機能異常、倦怠感、血中クレアチンホスホキナーゼ増加 |
*1) 自発報告又は海外のみで認められている副作用については頻度不明とした。*2) 投与中止後も持続したとの報告がある。
(解説)第Ⅱ/Ⅲ相国際共同試験(ARI114263 試験)及び国内臨床試験(ARI114264 試験)において多く認められた副作用、注意喚起が必要な副作用を記載している。性機能不全(リビドー減退、勃起不全、射精障害)については、本剤投与中止後も持続したとの報告があるが、本剤との関連性や作用機序は不明である。なお、海外のみで報告されている副作用については、頻度不明として記載している。
まずはお気軽に当院にご相談ください
 0120-237722
0120-237722
 オンライン診療
オンライン診療
AGAに関する情報を探す
当院の治療方法
浜松町第一クリニックでは、患者様に問診を実施し、厚生労働省に認可されたAGA治療薬を処方しております。AGAは早い人で10代後半から始まることがあり、30代・40代に発症率が高まり、進行していきます。そのAGAの進行を抑えたり改善できる治療法はあるものの、完治というより長期的なコントロールが必要なものです。フィナステリドやデュタステリドの内服薬、ミノキシジル外用薬で進行を抑制することはできますので、まずは当院にご相談(来院またはオンライン)ください。
すぐ処方
(初診も対応)
のみで安心
マネー対応
院内処方
・保険証不要
(年末年始を除く)
アクセス良好
カードOK
まずはお気軽に当院にご相談ください
カルプロニウム塩化物(5%)
浜松町第一クリニックで取り扱っている医薬品はすべて厚労省の 認可を得ている国内正規品です。 安全性が保証されていない 海外製の薬は一切使っていませんのでご安心ください。
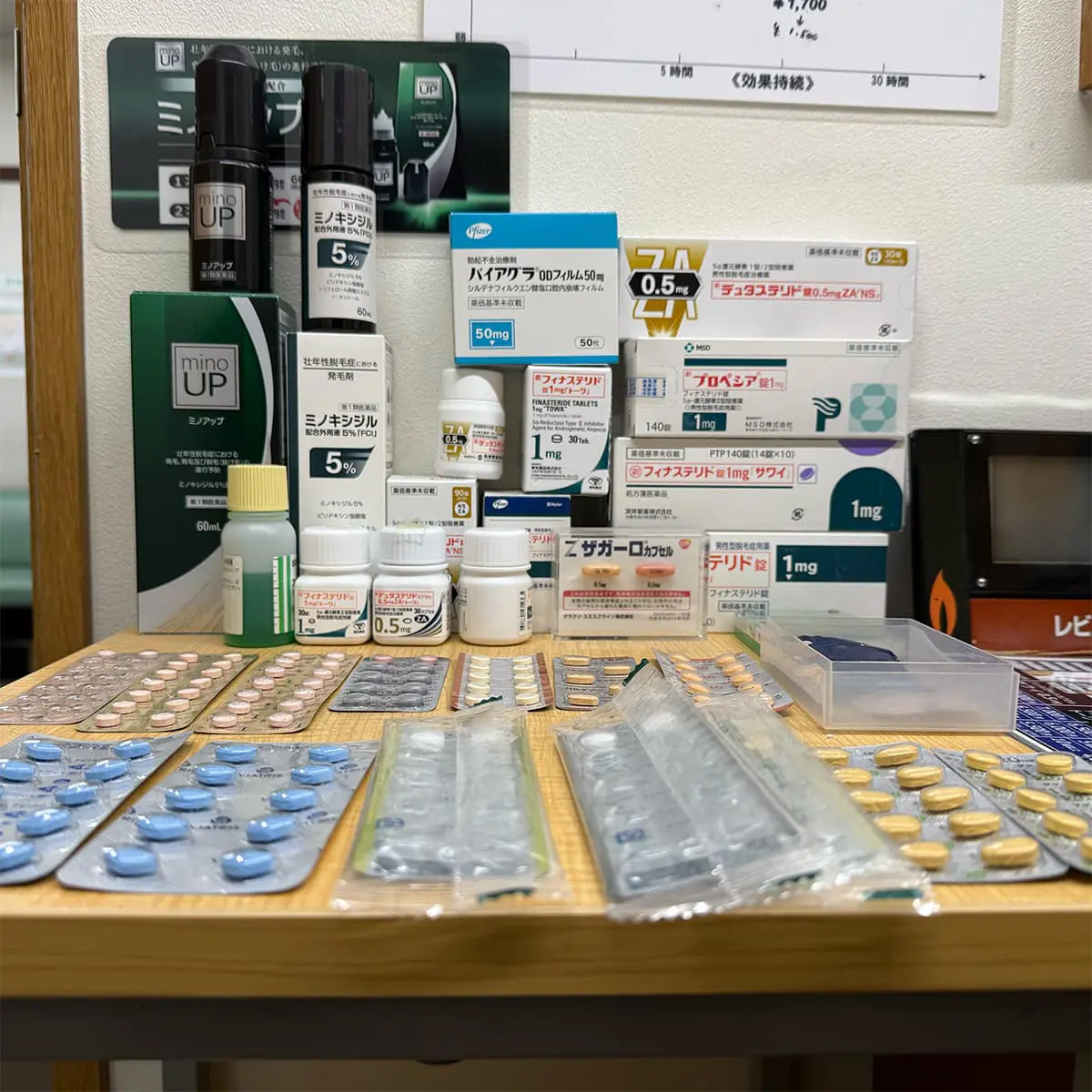
安全なAGA治療を第一選択に!
フィナステリド、デュタステリドの有効性は非常に高いうえ、副作用が少ないことからも治療の第一選択です。またミノキシジルの外用薬も効果が証明されており、上記の内服薬と併用することも推奨しています。
AGA治療薬は一般用医薬品の第一類医薬品に分類されるため、AGAの専門治療を行っている当院や医療機関にご相談ください。当院では外用薬としてミノキシジル5%等を取り扱っております。
まずは郵送処方を
試してみるのがオススメです!